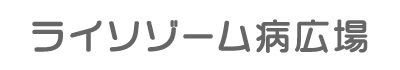
ムコ多糖症の症状
MPSの型が異なっていても、グリコサミノグリカンの貯蔵が骨、結合組織、臓器などに影響を与えるため、共通している症状があります。ただし症状の重さには幅があり、また出生時にすでに明らかなこともあれば、成長してから顕著になるものもあります。
共通する症状
・粗い顔貌(平坦な鼻梁、厚い唇、肥大した舌など)
・低身長および不釣り合いに短い体幹
・骨の大きさや形の異常(形成不全)
・関節のこわばり
・肥厚した皮膚
・肝臓や脾臓などの肥大
・臍ヘルニア・鼠経ヘルニア
・反復する呼吸器感染症、閉塞性気道疾患、閉塞性睡眠時無呼吸症候群
・心臓病(心臓弁の肥大を伴うことが多い)
・脳神経系の症状には、知的障害や発達の遅れ、多動、抑うつ視などを有する場合もある。
・視力、聴力の障害

各型の発症の特徴
発症年齢は様々ですが、一般的には小児期に発症します。多くは正常に発育する時期を経て、身体や精神機能の低下をきたします。またMPSの中には、生後数ヵ月で死に至るものもあります。
MPS I(ハーラー症候群/シャイエ症候群)
MPS I(ハーラー症候群/シャイエ症候群)MPS Iでは、デルマタン硫酸とヘパラン硫酸の分解に必要なα-L-イズロニダーゼという酵素が欠損しているか、あるいは欠乏しています。重症型(ハーラー症候群)は、1歳までに発達遅滞がみられ、通常2~4歳で発達が停止します。その後、精神的・身体的な機能の低下が進行します。低身長、骨格異常、ヘルニア、特有の顔貌、臓器の肥大などを認め、閉塞性気道疾患、呼吸器感染症、心臓の合併症のために10歳未満で亡くなることが多いです。軽症型(シャイエ症候群)では、知能は正常で、呼吸器疾患、睡眠時無呼吸、心臓疾患は、思春期に発症することもあります。

MPS II(ハンター症候群)
イズロン酸-2-スルファターゼという酵素の欠損によって起こります。MPS IIは、ムコ多糖症の中で唯一X連鎖劣性遺伝の形式をとり、ほぼ男児にのみみられます。重症MPS IIは、通常2~4歳に発症し、重症MPS I型に似た特徴を有します。その他に、頭蓋内圧亢進(水頭症)、関節のこわばり、視覚障害、進行性難聴などがみられ、通常15歳までに亡くなります。軽症のMPS IIは、10歳頃に診断されることが多く、知能や社会性の発達には影響はみられません。
MPS III(サンフィリッポ症候群)
4つの型(A〜D)があり、いずれもヘパラン硫酸の分解に必要な酵素の欠乏が原因です。4つの型に臨床的な違いはほぼありませんが、A型は症状が最も重く、進行も早くなります。MPS IIIは、行動の特性(攻撃性、多動性)、睡眠障害、進行性の認知障害(記憶喪失、知的障害など)、難聴、視力障害を特徴とします。通常は2~6歳の間に学習能力が著しく低下し、最終的に言語能力や聴覚が失われますが、その進行速度には、個人差があります。病気が進行するにつれて、歩行が不安定になり、10歳までに歩けなくなってしまうこともあります。
MPS IV(モルキオ症候群)
コンドロイチン-6-硫酸とケラタン硫酸の分解に必要なN-アセチルガラクトサミン-6-スルファターゼ(A型)またはβ-ガラクトシダーゼ(B型)の欠損または欠乏に起因する2つの亜型があります。症状は、骨格形成不全(骨と軟骨の成長障害)、難聴、視力障害(角膜の混濁)などがあります。頚椎の異常を伴い、手術が必要となることもあります。その他にも、胸骨の突出、背骨の湾曲、X脚などがあります。MPS IVでは、進行する骨格の変形により神経が圧迫されることもありますが、知能は影響を受けません。MPS IVは通常1~3歳に発症し、8歳前後で成長が止まります。重症のMPS IV(A型)では、20~30歳代までしか生きられないこともあります。
MPS VI(マロトー・ラミー症候群)
N-アセチルガラクトサミン4-スルファターゼという酵素の欠損が原因です。症状は多岐にわたり、重症度も個人差があります。MPS VIでは、重症MPS Iにみられる身体症状の多くが共通してみられます。硬膜(脳と脊髄を保護する膜)が厚くなり、聴力や視力に異常を生じるほか、肝臓や脾臓の肥大、心臓疾患、呼吸器症状なども認めます。MPS VIでは、幼児期に症状が現れ始め、8歳頃に成長が止まってしまいます。骨格の変化は徐々に悪化し、運動能力が制限されます。平均余命は重症度によって異なりますが、通常20~30歳程度です。知的な発達の遅れはありません。
MPS VII(スライ症候群)
β-D-グルクロニダーゼという酵素の欠損により、デルマタン硫酸、ヘパラン硫酸、コンドロイチン硫酸の3種類のグリコサミノグリカンが蓄積します。MPS VIIでは、軽度から中等度の知的障害、水頭症、心臓疾患、角膜混濁による視力低下、手根管症候群を伴うことがあります。関節のこわばりによる運動制限や低身長などもみられます。生後数年間で肺炎を繰り返すこともあります。多くは青年期まで生きることができますが、まれに出生前に異常な体液貯留(胎児水腫)を認めることがあります。この場合の生存期間は、通常数ヵ月です。
MPS IX(ナトヴィッチ症候群)
極めてまれで、日本での報告例はありません。
ムコ多糖症の診断
MPSの早期診断は非常に重要であり、早期に治療を開始することで病状の進行を遅らせることができるかもしれません。
まず臨床所見からMPSが疑われる場合、尿中のムコ多糖(ウコン酸)を検出する検査を行います。
その後、血液や皮膚組織を採取して、酵素活性(酵素の働き)を調べることによって、MPSの病型の鑑別を行います。必要であれば、さらに遺伝子検査を行うこともあります。
ムコ多糖症の治療
現在のところ、MPSを根治させる治療法はありません。いずれも症状の緩和や進行を遅らせることが、主たる治療目的になります。
酵素補充療法は、不足している酵素を点滴で体内に入れる方法です。現在MPS I、MPS II、MPS IV A、MPS VI、MPS VIIに使用されています。なお、今まで酵素は脳内に移行しないため、視力やその他の神経系の症状には効果がありませんでしたが、現在Ⅱ型では神経系の症状に対する酵素製剤も使えるようになりました。
足りない酵素を体内で作ることができるように、骨髄移植と臍帯血移植を行うこともあります。まだ効果は限定的ですが、早期に行うことで、神経症状への効果も期待できます。
そのほかにも、症状を緩和させるための治療も行います。
参考文献
早期発見の大切さ
ムコ多糖患症Ⅵ型では、5歳6か月と生後6週間から早期に治療(酵素補充療法)を開始した、兄妹の症例があります。
お兄さんは、2歳のとき言葉の遅れがみられていましたが、酵素補充療法を開始後、聴力の改善により言葉の遅れは全く認めず、精神運動発達は正常範囲で経過しています。また、妹さんも出生時にムコ多糖症Ⅵ型であることがわかり、生後6週間から治療を開始。治療開始後は、関節症状はほとんど認めず、聴力も正常範囲内を保てています。
ムコ多糖症Ⅵ型を含むライソゾーム病は、症状が出る前に診断をすることが非常に難しい病気です。しかし、早期発見、早期に治療を開始することで、今回のような長期の予後が改善された例もあります。また、現在では拡大スクリーニングの対象疾患となっており、実施している自治体も増えてきています。
出産の際はスクリーニングを受けたり、疑われる症状があった際は、早いタイミングで医療機関へ受診しましょう。

監修医:独立行政法人国立病院機構 岡山医療センター 小児科医長 古城真秀子 先生